Mogelijk wordt u gevraagd om het elektron configuratie van een atoom op een chemie test te schrijven, maar het is makkelijker dan het lijkt. Hier is hoe te beginnen.
Stappen
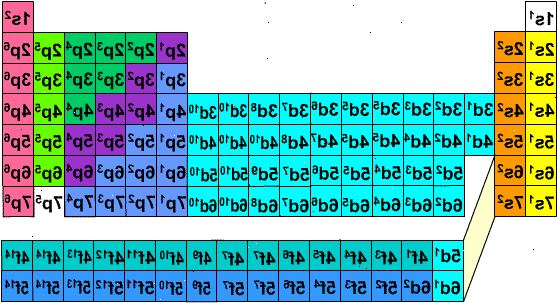
- 1Bepaal het aantal elektronen in het atoom. Het atoomnummer (op het periodiek systeem) is het aantal protonen van het atoom, en dus gelijk aan het aantal elektronen in een atoom met nul last.
- 2Als u werkt met een geladen atoom, toe te voegen of daarvan af te trekken elektronen. Bijvoorbeeld een natrium-atoom met een negatieve lading zou nog electron naast het atoomnummer van 11, waardoor 12 elektronen.
- 3Onthouden de basislijst van orbitalen. Zodra u de bestelling van orbitalen weet, kunt u gewoon te vullen volgens het aantal elektronen in het atoom.
- De s orbitale set (elk nummer gevolgd door een "s") bevat een orbitaal, en van Pauli's Uitsluiting Principe, een orbitale kan maximaal 2 elektronen te houden, zodat iedere s orbitale set kan houden 2 elektronen.
- De p orbitale set bevat 3 orbitalen, en kan dus in totaal 6 elektronen houden.
- De d orbitale set bevat 5 orbitalen, zodat het kan vasthouden 10 elektronen.
- De f orbitale set bevat 7 orbitalen, zodat het kan vasthouden 14 elektronen.
- Onthouden de volgorde van de orbitalen. Merk op dat orbitale sets zijn genummerd door elektronenschil, maar besteld in termen van energie. Bijvoorbeeld, een gevulde 4s 2 lager energie (of minder potentieel explosief) dan een gedeeltelijk gevulde of gevulde 3d 10, zodat de 4s shell staat bovenaan.
- 4Zet een elektron in de hoogste energie-orbitale beschikbaar, te beginnen met 1s (kan maximaal twee elektronen). Wees voorzichtig niet de orbitalen in de volgorde zoals aangegeven in de tabel te vullen Vul de orbitalen in deze volgorde (het nummer na de orbitale set is het maximale aantal elektronen het kan houden)!:
- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
- Merk op dat de bovenstaande lijst, wanneer alle schelpen werden vervuld, zou het elektron configuratie voor UUO (ununoctium), 118, de hoogst genummerde atoom in het periodiek systeem - dus dit elektron configuratie bevat elk moment bekend elektronenschil voor een neutraal geladen atoom.
- Opmerking: Energie-level verandert als je omhoog gaat. Bijvoorbeeld, wanneer je op het punt om te gaan naar de 4e energieniveau, 4s wordt het eerst, daarna 3d. Na de vierde energieniveau, zal je verplaatsen naar de 5e, waar zij de order opnieuw volgt. Dit gebeurt pas na de 3e energieniveau.
- 5Vul de orbitalen volgens het aantal elektronen in het atoom.
Alternatieve methode
Er is een alternatieve methode waarbij elektronenconfiguraties dat noch memoriseren of mnemonic diagram vereist. Echter, het vereist herschikt periodiek systeem, omdat in de traditionele periodiek systeem, te beginnen met de vierde rij, hoeft periode aantallen niet overeen met het elektron schelpen.
In Adomah Periodiek Systeem, ontworpen door V. Tsimmerman, horizontale rijen vormen groepen elementen, zoals halogenen, inerte gassen, alkalimetalen, aardalkalimetalen, etc. verticale kolommen komen elektronenschillen en zogenaamde "cascade" overeen met periodes (wanneer diagonale lijnen verbinden s, p, d en f blokken worden gevolgd). Helium wordt naar waterstof, omdat beiden worden gekenmerkt door de elektronen die zich in dezelfde orbitaal. Blokken van periodes (s, p, d en f) worden afgebeeld op de rechterkant en shell nummers staan aan de basis. Opsomming is in rechthoekige dozen die zijn genummerd 1-120. Die aantallen zijn atoomnummers die vertegenwoordigen ook totaal aantal elektronen in een neutraal atoom genoemd. Deze regeling maakt het schrijven elektronenconfiguraties heel eenvoudig:
- 1Afdrukken kopie van Adomah periodiek systeem van deze website: ( www.perfectperiodictable.com/Images/Binder1 ). Om elektronen configuratie van een element te schrijven, vindt haar symbool in Adomah Periodiek Systeem en doorstrepen alle elementen die hogere atoomnummers hebben. Bijvoorbeeld, als je nodig hebt om elektronen configuratie van Erbium (68) schrijven, doorhalen elementen 69 tot 120. Opmerking nummers 1 tot 8 bij de basis van de tabel. Dat zijn elektronenschil nummers, of kolom getallen. Negeer kolommen die alleen bevatten doorgestreept elementen. Voor Erbium resterende kolommen zijn 1,2,3,4,5 en 6.
- 2Kijkend naar de blok symbolen afgebeeld op de rechterkant van de tafel (s, p, d, en f) en in de kolom nummers die aan de basis en het negeren van diagonale lijnen tussen de blokken, verdeel kolommen in kolom-blokken en een lijst van hen in volgorde van beneden naar boven. Nogmaals, negeer kolomblokken waar alle elementen zijn doorgestreept. Noteer de kolom-blokken beginnen met de kolom gevolgd door het blok symbool, zoals deze: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (in geval van Erbium). Zie opmerking hieronder. *
- 3Tellen elementen die niet in elk blok-kolom werden gekruist en noteer de hoeveelheid naast het blok symbolen voor elk blok-kolom, zoals deze: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2. Dat is de elektronenconfiguratie van Erbium. (Zie toelichting hieronder).
- 4Er zijn achttien gemeenschappelijke uitzonderingen elektronenconfiguraties voor atomen in de laagste energietoestand, ook wel de grondtoestand. Ze wijken af van de algemene regel alleen laatste twee tot drie elektron posities. Hier zijn ze: Cr (..., 3d5, 4S1); Cu (..., 3D10, 4S1); Nb (..., 4d4, 5S1), Mo (..., 4D5, 5S1); Ru (..., 4d7, 5S1); Rh (..., 4D8, 5S1); Pd (..., 4D10, 5s0); Ag (..., 4D10, 5S1), La (..., 5D1, 6S2); Ce (..., 4F1, 5D1, 6S2); Gd (..., 4F7, 5D1, 6S2); Au (..., 5D10, 6S1); Ac (..., 6D1, 7S2), Th (..., 6D2, 7S2); Pa (..., 5F2, 6D1, 7S2), U (..., 5F3, 6D1, 7S2); Np (..., 5f4, 6D1, 7S2) en Cm (..., 5f7, 6D1, 7S2).
- Opmerking: De bovenstaande elektronen configuratie van Er is geschreven in de volgorde van oplopende schaal nummers. Het kan ook worden geschreven in de volgorde van orbitale vullen. Volg gewoon cascades van boven naar beneden in plaats van kolommen wanneer u de kolom-blokken neer te schrijven: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12.
Tips
- Er zijn omstandigheden waarin een elektron moet worden "bevorderd." Wanneer een orbitale set is een elektron verwijderd van de helft bezet of volledig bezet, verwijder dan een elektron van het dichtstbijzijnde s of p orbitaal set en verplaats het naar de orbitale set die het elektron nodig heeft.
- Wanneer het atoom een ion, betekent dat het aantal protonen het aantal elektronen niet gelijk. De lading van het atoom zal ze worden weergegeven in de rechterbovenhoek (meestal) hoek van het chemische symbool. Dus, een antimoon atoom met lading 2 heeft een elektron configuratie van 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1. Merk op dat de 5p 3 veranderd in een 1 5p. Wees voorzichtig bij de configuratie van een ongeladen atoom eindigt in iets anders dan een s-en p orbitaal set. Wanneer u weg elektronen te nemen, kunt u alleen nemen ze afstand van de valentie orbitalen (de s en p orbitalen). Dus als een configuratie eindigt in 4s 2 3d 7, en het atoom krijgt een lading van 2, dan is de configuratie zou veranderen te eindigen met 4s 0 3d 7. Merk op dat 3d 7 niet verandert, maar de s orbitale elektronen verloren.
- Er is niet zoiets als de "stabiliteit van een half gevulde" subniveau. Het is een oversimplificatie. Elke stabiliteit betreffende "halfvol" subniveaus komt door het feit dat elk afzonderlijk orbitaal is bezet, waardoor elektronen-afstotende elektronen geminimaliseerd.
- U kunt ook elektron configuratie van een element te schrijven door gewoon de valentie configuratie schrijven, dat is de laatste jaren en p orbitaal set. Dus, zou de valentie configuratie van een antimoon atoom 5s 2 5p 3 zijn.
- Om het atoomnummer van het atoom vinden wanneer het in elektronenconfiguratie vorm, tel dan alle getallen die de letters (s, p, d en f) volgen.
- Het schrijven van lange elektronenconfiguraties kan worden vermeden door ze op te schrijven in hun edelgas configuraties. Met behulp van een elektron configuratie die is geschreven in de volgorde van de orbitale vullen, vinden de laatste symbool met p6 (zoals 3p 6 of 5p 6) en tel al van de cijfers na de letters van elk symbool vóór en met inbegrip van de p6 orbitale set. Dan, met behulp van de som van de getallen, zoek het element met het atoomnummer gelijk aan de som die u zojuist berekend. Het moet verschijnen op het recht van het periodiek systeem. Dat heet een edelgas. Nu, gewoon verwijderen van alle van de symbolen die u opgeteld en zet in het symbool van de edelgas "tussen haakjes. Dus, voor een antimoon atoom, het edele gas configuratie zou [Kr] 5s 2 4d 10 5p 3 zijn. Merk op dat je niet optellen van de 5s 2 en 4d 10 omdat ze na 4p 6, en dat doe je toevoegt.
- Ionen zijn niet hetzelfde. Ze zijn veel harder. Overslaan twee niveaus en volgen hetzelfde patroon, afhankelijk van waar je begonnen bent, afhankelijk van hoe hoog of hoe laag het aantal elektronen is.
- Elk atoom wil stabiel te zijn, en de meest stabiele configuraties hebben volledige s en p (s2 en p6) orbitale sets. De edelgassen hebben deze configuratie, dat is waarom ze zelden reactief en op de rechterzijde van het periodiek systeem. Dus als een configuratie eindigt in 3p 4, heeft het slechts twee meer elektronen stabiel geworden (het verliezen van zes, waaronder de s orbitale set van elektronen, kost meer energie, dus het verliezen van vier is makkelijker). En als een configuratie eindigt in 4d 3, moet het slechts om drie elektronen verliezen aan een stabiele toestand te bereiken. Ook, half gevulde schalen (s1, p3, d5..) stabieler zijn dan bijvoorbeeld p4 of p2, maar s2 en p6 zal nog stabieler.
- Er zijn twee verschillende manieren om elektronenconfiguraties schrijven. Ze kunnen worden geschreven in de volgorde van oplopende schaal nummers, of de volgorde van orbitale vullen, zoals hierboven voor Erbium gepresenteerd.
- Het getal na de letter is eigenlijk superscript, dus die fout maken op een test.
